|
|||
| << Anterior Índice Siguiente >> | |||
|
Ampliaciones de Enlace Químico y Estructura de la Materia (1º Químicas) |
|
|||
| << Anterior Índice Siguiente >> | |||
|
Ampliaciones de Enlace Químico y Estructura de la Materia (1º Químicas) |
=====>![]() Disponible
en formato PDF
Disponible
en formato PDF
La ecuación de Schrödinger es irresoluble de forma exacta para átomos o iones con más de un electrón, lo que no se debe a su complejidad: complejidad e irresolubilidad no están necesariamente asociadas. De hecho, ecuaciones muy simples son también irresolubles de forma exacta. La solución exacta para una ecuación de segundo grado ax2 + bx + c = 0 se obtiene despejando la variable x:
Esta es una resolución analítica de la cual obtenemos una solución exacta. La mayoría de ecuaciones no se pueden resolver de esta forma.
En una ecuación tan sencilla como
no es posible despejar la variable x y obtener una solución analítica. Un primer método de resolución consiste en simplificar la ecuación para hacerla resoluble, eliminado uno o más de sus términos. Conviene escoger con cuidado las simplificaciones, para que afecten lo menos posible al resultado final. En la ecuación anterior, el valor de x debe ser bastante inferior a 1 pues la suma de los tres términos vale 10-2. En tal caso, el cuadrado y cubo de x serán mucho más pequeños que el propio x y podríamos despreciarlos:
obteniendo como solución aproximada, x = 1 10-2. Alternativamente, es posible utilizar un método numérico en el que se prueban valores que se modifican progresivamente mediante iteraciones para acercarse al resultado correcto. De hecho, la resolución ideal combina ambos métodos utilizando el primero para obtener una solución inicial, 1 10-2 en el ejemplo, que se modifica iterativamente hasta obtenerla con la precisión deseada, por ejemplo 1 10-2, 0,9 10-2, 0,95 10-2, 0,97 10-2, 0,99 10-2, 0,995 10-2, 0,993 10-2, 0,991 10-2, 0,990 10-2... Este tipo de cálculos los realiza de una forma rápida y eficaz un ordenador. La solución obtenida no será en muchas ocasiones exacta pues la solución exacta o bien tiene un número infinito de decimales o bien un número mucho mayor del que podemos o necesitamos determinar.
En la práctica, en un sistema físico no necesitamos soluciones exactas sino únicamente de la suficiente exactitud para el fin deseado. Cuando además, como es el caso de la ecuación de ondas, las soluciones son funciones de complejidad creciente con su exactitud, a veces es mejor llegar a un compromiso y renunciar a una descripción más exacta del sistema para utilizar otra más simple pero también más comprensible.Es habitual en Química realizar cálculos mecano-cuánticos inicialmente mediante métodos muy aproximados pero que permiten hacerse una idea cualitativa del problema, para a continuación confirmar la interpretación mediante cálculos más exactos y difícilmente interpretables pero que dan valores cuantitativos de, por ejemplo, la energía mucho más exactos.
Para resolver analíticamente una ecuación o un sistema de ecuaciones con varias variables hay que separar las diferentes variables que la componen. Así, el siguiente sistema de ecuaciones
se soluciona fácilmente pues las variables x e y están separadas en distintos términos:
Si en el sistema las variables no están ya separadas, el primer paso es hacerlo. Por ejemplo, en el sistema
podemos separar las variables x e y que están mezcladas en el tercer término de cada ecuación, restando la segunda de dos veces la primera, con lo que queda que
y sustituyendo x por 9 - 3y en, por ejemplo, la primera ecuación
de donde se deduce que y = 3 o 1/3 , x = 2 o 8.
De hecho este es el procedimiento que utilizamos para resolver la ecuación de Schrödinger para el átomo de hidrógeno, donde primero separamos f del resto de variables, y posteriormenteq y r.
Las ecuaciones, por sencillas que sean, de cualquier sistema físico de más de dos partículas interaccionando entre sí, por ejemplo, Sol-Tierra-Luna, son irresolubles de forma exacta. Situando el Sol en el centro de coordenadas, la irresolubilidad es debida a que no es posible separar las coordenadas que definen la trayectoria de la Tierra de aquellas que definen la de la Luna, pues ambas se afectan mutuamente. En otras palabras, no se puede conocer la trayectoria de la Tierra sin conocer previamente la de la Luna y viceversa.
En tales casos, hay que proceder a una resolución aproximada. Una forma de hacerlo en el ejemplo Sol-Tierra-Luna es despreciar alguna interacción. Así se puede obtener una trayectoria aproximada de la Tierra alrededor del Sol despreciando la influencia de la Luna, y la de la Luna alrededor de la Tierra despreciando la del Sol. Obsérvese que de esta manera se transforma un problema irresoluble de tres partículas (Sol-Tierra-Luna) en dos problemas resolubles, aunque aproximados, de dos partículas (Sol-Tierra y Tierra-Luna).
Un átomo como el de He está compuesto por tres partículas (un núcleo y dos electrones), interaccionando entre sí. Esta es la razón, y no la complejidad, de que la ecuación de Schrödinger sea irresoluble de forma exacta para el He, y por ende, para cualquier átomo o ion con más de un electrón.
Sin embargo, es posible obtener soluciones aproximadas despreciando las interacciones menos importantes, tal como propusimos para el sistema Sol-Tierra-Luna. En este caso, un procedimento lógico es despreciar las interacciones entre los electrones y considerar sólo la acción del núcleo sobre cada uno de los electrones. Este método de resolución se conoce con el nombre de aproximación orbital.
La aproximación orbital independiza a los electrones, en el sentido de que cada electrón sólo ve al núcleo y no al resto de electrones, por lo que el comportamiento esperable para él es el mismo que tendría si los otros electrones estuvieran ausentes. Hemos transformado un problema único de n electrones, que era irresoluble, en n problemas de un electrón que esperamos que sean resolubles, pues cada uno implica solamente a dos partículas (el núcleo y el electrón dado).
El resultado de tales consideraciones es fácilmente previsible. El comportamiento de cada electrón es el mismo que tendría en un átomo monoelectrónico cuyo núcleo tuviera una carga nuclear Z. Y sabemos que los estados posibles para un electrón en dichas circunstancias, las de un átomo monoelectrónico, son los orbitales atómicos hidrogenoides.
En definitiva, si se desprecian las interacciones entre electrones, el estado de un átomo polielectrónico se puede considerar que es la superposición de los estados individuales u orbitales atómicos de cada uno de los electrones. El nombre de aproximación orbital procede, por tanto, de que introduce en los átomos polielectrónicos la idea de orbital como estado de un electrón.
Convendría matizar la diferencia importante que existe entre un orbital de un átomo monoelectrónico como el hidrógeno y un orbital de un átomo polielectrónico. Un orbital atómico del hidrógeno es una solución exacta de la ecuación de ondas que representa uno de los estados de energía en que puede estar el átomo debido a su único electrón. Un orbital en un átomo polielectrónico representa el estado de energía de uno de sus electrones, y es el resultado de una aproximación, que desprecia las repulsiones interelectrónicas y permite hablar en términos de electrones independientes.
Veamos ahora el problema desde un punto de vista matemático. El helio, el ejemplo más simple de átomo polielectrónico, es un sistema formado por un núcleo y dos electrones:
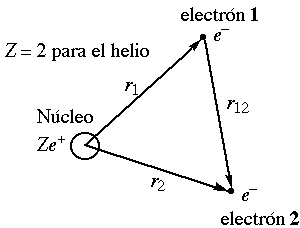
Aplicando este valor de potencial, la ecuación de Schrödinger queda:
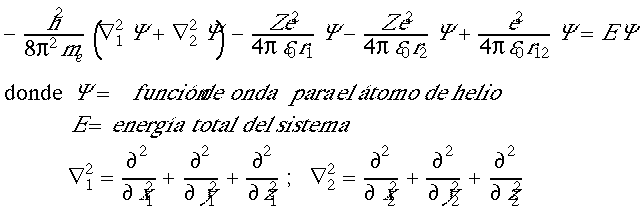
Todos los términos de la izquierda dependen o bien de las coordenadas de 1 o bien de las coordenadas de 2, con la única excepción del último, que representa la repulsión interelectrónica, y que al incluir la distancia r12 depende de las coordenadas de ambos electrones. Este término impide separar la ecuación en términos dependientes de las coordenadas de 1 y en términos dependientes de 2, y, de esa forma, resolver analíticamente la ecuación.
La aproximación orbital consiste en eliminar de la ecuación (1), el término de las repulsiones interelectrónicas.
La ecuación aproximada (2) es resoluble exactamente y sus soluciones son soluciones aproximadas de la ecuación exacta (1).
Si el razonamiento hecho anteriormente es válido, el estado del átomo de helio será la superposición de los estados individuales de cada uno de sus electrones. Expresado matemáticamente, esto significa que esperamos que la función
sea solución de la ecuación (2) si y1 y y2 son los estados de los electrones 1 y 2 respectivamente. Además, esperamos que estos estados electrónicos sean los mismos que los de un ion monoelectrónico de la misma carga nuclear Z. Es decir, esperamos que y1 y y2 sean las soluciones de las siguientes ecuaciones monoelectrónicas:
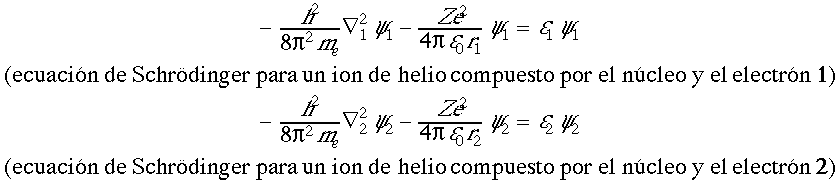
cuya forma son los orbitales atómicos hidrogenoides.
Vamos a demostrar que efectivamente, si y1 y y2 son soluciones de estas dos ecuaciones, el producto Y = y1 x y2 es también solución de la ecuación aproximada (2):
Obsérvese que además, y lógicamente, la energía total del sistema E es igual a la suma de las energías de los electrones individuales e1, e2:
Es decir, la energía total es la suma de la energía de cada uno de los orbitales atómicos ocupados.