| Páginas de Ernesto de Jesús Alcañiz |
|
Departamento de Química Inorgánica |
La VSEPR en imágenes interactivas 3D: Guía rápida para la aplicación de la VSEPR
|
|||
| Volver a índice VSEPR | |||
|
La VSEPR en imágenes interactivas 3D: Guía rápida para la aplicación de la VSEPR |
1 Escribe una estructura de Lewis para la molécula.
Por ejemplo, para XeO2F2: 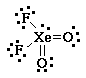
2 Cuenta los pares electrónicos que hay alrededor del átomo central.
Cuenta el total de:
- Pares de enlace.
- Pares solitarios
- Cada enlace múltiple (dobles, triples) lo cuentas como un par único.
En el ejemplo anterior:
2 enlaces sencillos
+ 2 enlaces dobles
+ 1 par solitario
= 53 Determina la geometría básica de los pares electrónicos según la VSEPR.
Número de pares
electrónicosDisposición geométrica 2 Lineal Para XeO2F2,
la geometría básica es una bipirámide trigonal.3 Triangular plana 4 Tetraédrica 5 Bipirámide trigonal 6 Octaédrica
4 Dibuja la geometría y coloca los pares solitarios, los enlaces múltiples y los sencillos.
En una bipirámide trigonal y en un octaedro, no todas las disposiciones obtenibles son equivalentes. Por ello hay que seguir un criterio a la hora de distribuir los pares solitarios, enlaces múltiples y enlaces sencillos.
Según la VSEPR, los pares solitarios y enlaces múltiples prefienen ocupar las posiciones de mayor espacio.
Así, para XeO2F2, los dos oxígenos y el par solitario ocupan las posiciones ecuatoriales de la bipirámide trigonal.
Por tanto, la molécula tiene forma de balancín.
Más ejemplos en las tablas 1-6.